Le cerveau : organe central du stress et de l’adaptation tout au long de la vie
Bruce S. McEwen, Ph.D.
The Rockefeller University, États-Unis
Introduction
Les importantes recherches menées par Gunnar, Herrera, Hostinar et Heim reposent sur des notions fondamentales concernant les interactions qui se produisent, tout au long de la vie, entre le cerveau et le corps. Notamment, le fait que le stress vécu en bas âge a clairement des répercussions durables sur les processus mentaux et physiques plus tard dans la vie et que ses effets accroissent les risques de troubles de l’humeur et d’anxiété ainsi que de maladies cardiovasculaires et d’autres maladies systémiques. Grâce aux progrès récents de la neuroscience et de la médecine modernes, on comprend de mieux en mieux les interactions cerveau-corps qui sont à la base de l’adaptation au stress et l’ensemble des maladies associées à l’exposition à un stress excessif et prolongé. Parmi les connaissances importantes que la recherche a permis d’acquérir, mentionnons la notion selon laquelle le cerveau est l’organe central du stress puisqu’il régule les grands systèmes ayant un rôle à jouer dans l’adaptation et l’apparition de certaines maladies et qu’il est lui‑même influencé par ces systèmes, et ce, tant aux niveaux structurel que fonctionnel. De plus, comme le démontrent Gunnar et ses collègues1 ainsi que Heim,2 ces effets se manifestent très tôt dans la vie. Une autre notion importante est celle qui concerne l’« allostasie » et la « surcharge allostatique » et qui renvoie aux effets protecteurs et néfastes des médiateurs du stress et du phénomène d’adaptation, de même qu’aux changements cumulatifs découlant d’un stress prolongé, du mode de vie et des comportements associés au stress chronique. À cette notion se rattache celle de « conditionnement biologique », selon laquelle les expériences de la petite enfance « s’infiltrent sous la peau » et accroissent l’incidence des effets cumulatifs d’un stress qui perdure et du mode de vie.1
Sujet
Les chercheurs ont fait des progrès notables dans la compréhension du rôle du cerveau en tant qu’organe central du stress. Le cerveau est bel et bien un élément clé dans les réactions adaptatives et les problèmes d’adaptation au stress puisqu’il détermine ce qui constitue une menace et, par conséquent, une source éventuelle de stress, et qu’il est à l’origine des réponses comportementales et de bon nombre des réactions physiologiques manifestées en présence de facteurs de stress, lesquelles peuvent être soit adaptives, soit dommageables.4,5 Le stress entraîne une communication bilatérale entre le cerveau et les systèmes cardiovasculaire, immunitaire et métabolique par l’intermédiaire du système nerveux autonome et de mécanismes endocriniens. Pour constater les répercussions du stress, il faut prendre en compte divers critères d’évaluation associés aux médiateurs du stress et à l’adaptation et observer les changements cumulatifs qu’ils ont sur le corps et le cerveau.
Problèmes
L’action des médiateurs du stress et l’adaptation se produisent de façon non linéaire (figure 1), ce qui signifie que bon nombre de ces médiateurs se régulent mutuellement de façon à la fois positive et négative, suivant une courbe de relation en forme de « U », selon un modèle qui est maintenant désigné sous le nom d’hormèse.7 Au-delà de la réaction de fuite ou de lutte (flight or fight) associée au stress aigu, certains événements de la vie quotidienne, y compris le mode de vie individuel, engendrent un type de stress chronique et finissent par taxer l’organisme (« surcharge allostatique »). Et pourtant, les hormones et autres médiateurs associés au stress et à l’adaptation offrent à l’organisme un effet protecteur à court terme et favorisent l’adaptation (« allostasie »).4,5,8 Ces systèmes sont régulés par le cerveau par l’intermédiaire de l’hypothalamus et de réponses relayées par les systèmes neuroendocrinien, nerveux et autonome. Des stimulus reçus par l’hypothalamus font intervenir des régions du cerveau comme l’amygdale, l’hippocampe et le cortex préfrontal, lesquelles répondent aux signaux hormonaux de concert avec l’hypothalamus.
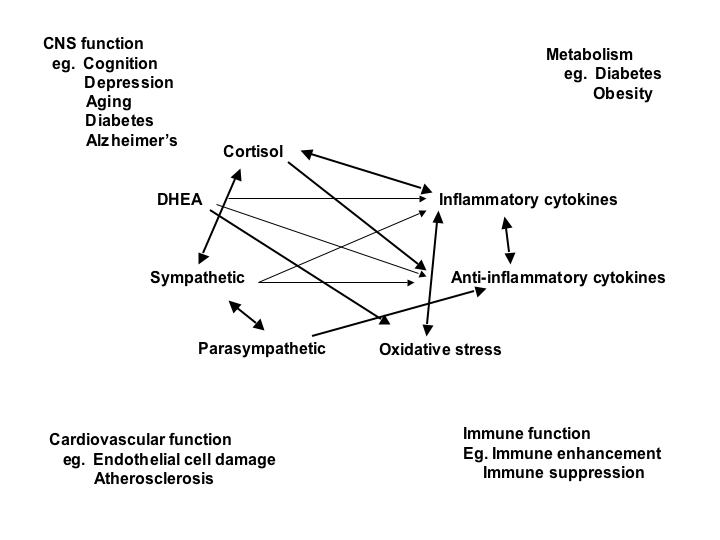
Figure 1. Réseau non linéaire de médiateurs responsables de l’allostasie intervenant dans la réaction au stress. Les flèches indiquent que les systèmes se régulent mutuellement, créant ainsi un réseau non linéaire. D’ailleurs, la régulation se fait de multiples façons – p. ex., la production de cytokines inflammatoires est régulée négativement par les cytokines anti-inflammatoires ainsi que par voie parasympathique et glucocorticoïde, alors que l’activité sympathique accroît la production de cytokines inflammatoires. L’activité parasympathique, pour sa part, module et limite l’activité sympathique. De plus, des médiateurs tels que le cortisol et les cytokines inflammatoires produisent des effets biphasiques qu’on désigne maintenant sous le nom d’hormèse (voir le texte). Reproduit avec l’autorisation de McEwen.6
Contexte de la recherche
L’évaluation de l’allostasie et de la surcharge allostatique repose sur la collecte de renseignements cliniques concernant les divers systèmes qui interviennent en situation de stress et jouent un rôle dans le phénomène d’adaptation, soit ceux qui forment l’axe hypotalamo-hypophyso-surrénalien (axe HHS), le système nerveux autonome et les paramètres métaboliques.9,10,12 Les mécanismes du cerveau qui contribuent à l’allostasie et à la surcharge allostatique peuvent être observés sur des sujets animaux au moyen de méthodes propres à la neuroscience moderne et appliqués aux sujets humains grâce à des techniques d’imagerie cérébrale en pleine évolution.13
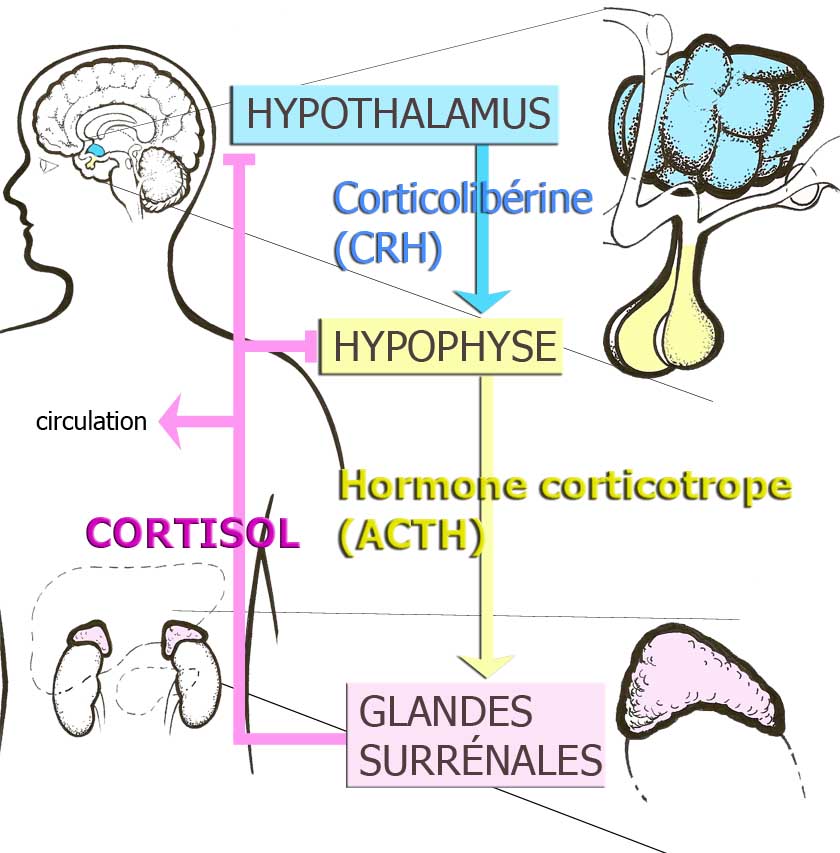
Figure 2. Axe hypotalamo-hypophyso-surrénalien ou axe de l'hormone du stress
Questions clés pour la recherche
Les expériences entourant les interactions et les événements sociaux dans l’environnement physique sont analysées par le cerveau et sont généralement englobées dans la notion de « stress ». Nous savons maintenant, d’après l’observation de sujets animaux, que les expériences vécues, y compris celles de stress chronique, entraînent des changements dans la structure et la fonction du cerveau et que ceux‑ci témoignent de la « plasticité adaptative » de cet organe, puisqu’ils sont en grande partie réversibles et qu’ils sont modulés en fonction des conditions qui les ont provoqués.3 Grâce aux progrès considérables réalisés dans le domaine de la neuroimagerie, il est maintenant possible d’étudier en détail le cerveau d’êtres humains vivants pendant qu’il réagit à des expériences stressantes à différentes étapes de la vie, de même que les liens qui existent entre la structure et les fonctions cérébrales, d’une part, et les états physiologiques de l’organisme, d’autre part.
Résultats récents de la recherche
Les modèles animaux ont aidé à comprendre comment le cerveau réagit au stress,5 dont il est la cible. Ainsi, l’hippocampe a été la première région du cerveau, après l’hypothalamus, à être reconnue comme un récepteur de glucocorticoïdes. On sait désormais que le stress ainsi que les hormones du stress peuvent à la fois favoriser et inhiber les réactions d’adaptation de cette région du cerveau, et ce, tout au long de la vie. Les événements qui surviennent pendant la petite enfance ont une incidence permanente sur la susceptibilité aux émotions et la réactivité au stress de même que sur le rythme de vieillissement du corps et du cerveau. Ainsi, sous l’effet des glucocorticoïdes, des acides aminés excitateurs, des hormones à activité métabolique et d’autres médiateurs intracellulaires et extracellulaires,5 le stress entraîne une réorganisation structurelle de l’amygdale, du cortex préfrontal et de l’hippocampe, modifiant ainsi les réponses comportementales et les réactions physiologiques telles que l’anxiété, l’agression, la flexibilité mentale, la mémoire et d’autres processus cognitifs.
Grâce à l’imagerie structurelle du cerveau humain, on commence à comprendre comment l’hippocampe se transforme selon les expériences vécues. Parmi les récents éléments probants étayant cette découverte, mentionnons le lien observé entre une exposition à un niveau élevé de stress perçu sur une période de 20 ans et une diminution du volume de l’hippocampe,14 ou encore la diminution de la taille de l'hippocampe lors de certains problèmes de santé comme la maladie de Cushing, la dépression majeure, le diabète et le trouble de stress post-traumatique (TSPT)15,16 ainsi que leurs états précurseurs, par exemple celui qui découle d’un décalage horaire chronique et d’un taux élevé de cytokines inflammatoires dans la circulation.18 On a également observé chez les jeunes et les personnes plus âgées ayant une faible estime de soi un volume de l’hippocampe inférieur à la normale, une forte activité de l’axe HHS et une incapacité de résister à des stress répétés.19
D’après les études menées sur des animaux, et tel qu’il est mentionné ci‑dessus, les mécanismes qui sous-tendent ces changements sont complexes et font vraisemblablement intervenir non seulement les glucocorticoïdes, mais aussi d’autres hormones et médiateurs. De plus, l’activité et la forme physiques chez les sujets âgés sont associées à un volume de l’hippocampe et à une fonction mnésique supérieurs,20 tout comme une activation accrue du cortex préfrontal est rattachée à la forme physique et à l’exercice régulier et débouche sur de meilleures fonctions exécutives.21,22
On a observé que chez les étudiants en médecine se préparant à l’examen d’entrée en pratique, une augmentation du niveau de stress perçu provoquait une altération temporaire mais réversible du cortex préfrontal.23 Par ailleurs, la taille de cette structure est plus petite chez les personnes souffrant de dépression majeure24 et celles qui déclarent avoir un statut socioéconomique inférieur.25 L’activation fonctionnelle du cortex préfrontal est liée à des changements de pression artérielle,24 tandis que celle de l’amygdale est associée à une réaction négative devant des visages inspirant la frayeur,27 laquelle est exacerbée chez les personnes ayant subi un traumatisme dans l’enfance.28 Une activité fonctionnelle élevée de l’amygdale est également rattachée au développement de l’athérosclérose.29
Les recherches effectuées sur des animaux nous révèlent que les effets des expériences vécues, notamment la réorganisation structurelle du cerveau causée par le stress, sont dans une grande mesure réversibles et que la résilience, tant au niveau de la structure cérébrale que du comportement, est un facteur essentiel à l’adaptation à des milieux changeants.5 L’absence de résilience est donc un indicateur de mauvaise adaptation et de diverses maladies, notamment les troubles anxieux et dépressifs, ainsi que des répercussions que celles‑ci ont sur le reste du corps par l’intermédiaire des systèmes nerveux autonome, neuroendocrinien et immunitaire. Mais jusqu’à quel point le cerveau humain peut-il être modifié par des interventions qui traitent efficacement des troubles touchant le cerveau ainsi que le reste de l’organisme?
Bien qu’il existe encore peu de données à cet égard, quelques études longitudinales portant sur les mêmes sujets ont mis en lumière des changements dans l’activité fonctionnelle30 et dans la structure du cortex préfrontal31 chez les patients ayant suivi avec succès des thérapies comportementales visant à traiter respectivement un trouble obsessionnel-compulsif (TOC) et de la fatigue chronique. Une autre étude, transversale cette fois‑ci, a révélé un accroissement de l’épaisseur du cortex dans l’insula antérieure de l’hémisphère droit et le cortex préfrontal des sujets qui pratiquaient la méditation depuis de nombreuses années comparativement aux témoins appariés.32 Il est bien connu que, lorsqu’elles sont combinées à des médicaments, les interventions sociales et comportementales, y compris l’activité physique régulière et un soutien social, peuvent réduire le fardeau du stress chronique et améliorer la santé et la résilience du cerveau et de l’organisme.5 C’est pourquoi les études visant à déterminer comment les thérapies comportementales et pharmaceutiques influent sur le cerveau sont d’importantes applications futures de l’imagerie cérébrale.
Lacunes de la recherche
L’expérience nous enseigne que le milieu social et physique dans lequel les personnes vivent et travaillent a une incidence considérable sur leurs états psychologiques. La nature de ces milieux a également des répercussions sur la santé physique et mentale de ces personnes et les risques qu’elles contractent une maladie. Or, l’étude scientifique de cet important sujet a été entravée et fragmentée par les démarcations établies entre différentes disciplines telles que l’écotoxicologie, la psychologie sociale, la sociologie, la psychologie de la santé, l’économie, l’épidémiologie, la psychiatrie, la pédiatrie, la neurologie et la médecine. Par conséquent, seule une partie des connaissances considérables que nous possédons à ce sujet ont été intégrées, et encore de manière arbitraire, dans la pratique et l’enseignement généraux de la médecine. En outre, la neuroscience a été presque totalement écartée de la question jusqu’à tout récemment. Si bien qu’on n’a pas encore pleinement reconnu le rôle central que joue le cerveau dans l’adaptation physiologique et face aux effets du stress, ni le fait qu’il est une cible du stress et des comportements connexes.5 Il n’existe donc à l’heure actuelle aucun cadre conceptuel à cet égard. Les choses commencent cependant à changer grâce aux résultats de recherches menées sur des animaux maintenant applicable chez les humains, au moyen des techniques d’imagerie cérébrale mentionnées ci‑dessus.
La plupart de l'information sur l’imagerie du cerveau proviennent d’études transversales, lesquelles permettent uniquement de formuler des hypothèses sur la cause d’un phénomène. Les interventions visant à améliorer la fonction cérébrale et à traiter les troubles du comportement rendent les études longitudinales sur la structure et la fonction du cerveau non seulement possibles, mais essentielles, pour confirmer ce lien de causalité. Tel qu’il est indiqué ci‑dessus, le meilleur exemple à cet égard concerne les effets bénéfiques de l’activité physique. Un autre domaine important où les données de cette nature sont incomplètes est celui des effets sur le cerveau du diabète de type 2, susmentionnés. Il sera donc nécessaire de mener des études portant sur le cerveau en développement et les répercussions du diabète de type 2 lorsqu’il se déclare pendant l’enfance.
Conclusions
Les répercussions durables sur le corps du stress précoce doivent être examinées dans le contexte de l’ensemble d’une vie et tenir compte du rôle central du cerveau en ce qui a trait aux effets protecteurs et dommageables des médiateurs physiologiques du stress et de l’adaptation. On commence à peine à comprendre, grâce aux modèles animaux et à des études reposant sur l’imagerie cérébrale, les effets considérables sur le cerveau du stress vécu pendant la petite enfance.33 On étudie désormais ceux‑ci en fonction des fluctuations des médiateurs qui interviennent dans l’allostasie et la surcharge allostatique,34 puisque, comme l’expliquent les paragraphes qui précèdent, les hormones du stress et à activité métabolique qui circulent dans l’organisme ont une incidence importante sur le cerveau. En ce qui concerne les documents de recherche publiés par Gunnar et ses collègues1 ainsi que par Heim,2 il est possible d’envisager de laborieuses études longitudinales du cerveau débutant dans la petite enfance des sujets et s’échelonnant sur toute leur vie, mais il serait sans doute plus réaliste de mener des études à plus court terme concernant les répercussions des traumatismes sur le développement du cerveau qui reposeraient sur des mesures des fonctions cognitives et physiologiques et inspirées d’études récentes de portée plus réduite.34,35 Cependant, il serait encore plus utile d’évaluer dans le temps l’incidence des interventions visant à améliorer les effets des traumatismes vécus en bas âge, en se fondant, par exemple, sur le programme Nurse-Family Partnership.a
Implications
Le milieu social et physique dans lequel nous évoluons a une profonde incidence sur les interactions corps-cerveau. Comme il est façonné en partie par les pratiques et politiques de l’entreprise privée et du gouvernement, il est possible de le modifier par l’adoption de nouvelles politiques. En fait, la presque totalité des décisions prises par les gouvernements et le monde des affaires influent sur notre santé et sont susceptibles d’avoir ultimement, par leur effet sur le cerveau, des répercussions sur tous les systèmes physiologiques intervenant dans la réponse au stress et l’adaptation.3 Par exemple, les programmes qui font la promotion de l’activité physique contribuent généralement à améliorer les fonctions cérébrales (voir ci‑dessus), tout comme les programmes tels Experience Corps procurent de nombreux bienfaits physiques et mentaux aux bénévoles âgés qui y prennent part.34 De même, il serait pertinent d’inclure une évaluation des fonctions cognitives et de la santé du cerveau dans les études visant à déterminer l’efficacité de programmes pour enfants tels que le Perry School Project.b Dans ce contexte, un examen de l’incidence de ces politiques sur le cerveau représente une autre application fort importante de la recherche fondée sur la neuroimagerie parce que les modèles animaux peuvent certes offrir des éléments de réponse, mais le but ultime n’est‑il pas une meilleure connaissance de la faculté d’adaptation du cerveau humain?
Références
- Shonkoff JP, Boyce WT, McEwen BS. Neuroscience, molecular biology, and the childhood roots of health disparities. JAMA: Journal of the American Medical Association 2009;301(21):2252-2259.
- McEwen BS. Protective and damaging effects of stress mediators. New England Journal of Medicine 1998;338(3):171-179.
- McEwen BS. Physiology and neurobiology of stress and adaptation: Central role of the brain. Physiology Reviews 2007;87(3):873-904.
- McEwen BS. Protective and damaging effects of stress mediators: Central role of the brain. Dialogues in Clinical Neurosciences 2006;8(4):367-381.
- Calabrese EJ. Neuroscience and hormesis: Overview and general findings. Critical Review in Toxicology 2008;38(4):249-252.
- McEwen BS, Wingfield JC. The concept of allostasis in biology and biomedicine. Hormones and Behavior 2003;43(1):2-15.
- Karlamangla AS, Singer BH, Seeman TE. Reduction in allostatic load in older adults is associated with lower all-cause mortality risk: MacArthur Studies of Successful Aging. Psychosomatic Medicine 2006;68(3):500-507.
- Seeman TE, Crimmins E, Huang MH, Singer B, Bucur A, Gruenewald T, Berkman LF, Reuben DB. Cumulative biological risk and socio-economic differences in mortality: MacArthur studies of successful aging. Social Science & Medicine 2004;58(10):1985-1997.
- Seeman TE, McEwen BS, Rowe JW, Singer BH. Allostatic load as a marker of cumulative biological risk: MacArthur studies of successful aging. Proceedings of the National Academy of Sciences of the United States of America 2001;98(8):4770-4775.
- Seeman TE, Singer BH, Ryff CD, Dienberg G, Levy-Storms L. Social relationships, gender, and allostatic load across two age cohorts. Psychosomatic Medicine 2002;64(3):395-406.
- McEwen BS. The physiology and neurobiology of stress and adaptation: Central role of the brain. Physiological Reviews 2007;87(3):873-904.
- Gianaros PJ, Jennings JR, Sheu LK, Greer PJ, Kuller LH, Matthews KA. Prospective reports of chronic life stress predict decreased grey matter volume in the hippocampus. Neuroimage 2007;35(2):795-803.
- Gold SM, Dziobek I, Sweat V, Tirsi A, Rogers K, Bruehl H, Tsui W, Richardson S, Javier E, Convit A. Hippocampal damage and memory impairments as possible early brain complications of type 2 diabetes. Diabetologia 50(4):711-719.
- Sheline YI. Neuroimaging studies of mood disorder effects on the brain. Biological Psychiatry 2003;54(3):338-352.
- Cho K. Chronic ‘jet lag’ produces temporal lobe atrophy and spatial cognitive deficits. Nature Neuroscience2001;4(6):567-568.
- Marsland AL, Gianaros PJ, Abramowitch SM, Manuck SB, Hariri AR. Interleukin-6 covaries inversely with hippocampal grey matter volume in middle-aged adults. Biological Psychiatry 2008;64(4):484-490.
- Pruessner JC, Balwin MW, Dedovic K, Renwick R, Mahani NK, Lord C, Meaney M, Lupien S. Self-esteem, locus of control, hippocampal volume, and cortisol regulation in young and old adulthood. Neuroimage 2005;28(4):815-826.
- Yamada K, Nabeshima T. Stress-induced behavioral responses and multiple opioid systems in the brain. Behavioural Brain Research 1995;67(2):133-145.
- Colcombe SJ, Kramer AF, McAuley E, Erickson KI, Scalf P. Neurocognitive aging and cardiovascular fitness: Recent findings and future directions. Journal of Molcular Neuroscience 2004;24(1):9-14.
- Kramer AF, Hahn S, Cohen NJ, Banish MT, McAuley E, Harrison CR, Chason J, Vakil E, Bardell L, Boileau RA, Colcombe A. Ageing, fitness and neurocognitive function. Nature 1999;400(6743):418-419.
- Abe H, Keen KL, Terasawa E. Rapid action of estrogens on intracellular calcium oscillations in primate luteinizing hormone-releasing hormone-1 neurons. Endocrinology 2008;149(3):1155-1162.
- Drevets WC, Price JL, Simpson JR Jr, Todd RD, Reich T, Vannier M, Raichle ME. Subgenual prefrontal cortex abnormalities in mood disorders. Nature 386(6627):824-827.
- Gianaros PJ, Horenstein JA, Cohen S, Matthews KA, Brown SM, Flory JD, Critchley HD, Manuck SB, Hariri AR. Perigenual anterior cingulate morphology covaries with perceived social standing. Social Cognitive and Affective Neuroscience 2007;2(3):161-173.
- Gianaros PJ, Sheu LK, Matthews KA, Jennings JR, Manuck SB, Hariri AR. Individual differences in stressor-evoked blood pressure reactivity vary with activation, volume, and functional connectivity of the amygdala. Journal of Neuroscience 2008;28(4):990-999.
- Olsson A, Phelps EA. Social learning of fear. Nature Neuroscience 2007;10(9):1095-1102.
- Gianaros PJ, Jennings JR, Sheu LK, Derbyshire SW, Matthews KA. Heightened functional neural activation to psychological stress covaries with exaggerated blood pressure. Hypertension 2007;49(1):134-140.
- Weil ZM, Norman GJ, Barker JM. Social isolation potentiates cell death and inflammatory responses after global ischemia. Molecular Psychiatry 2008;13(10):913-915.
- Schwartz JM, Stoessel PW, Baxter LR Jr, Martin KM, Phelps ME. Systematic changes in cerebral glucose metabolic rate after successful behavior modification treatment of obsessive-compulsive disorder. Archives of General Psychiatry 1996;53(2):109-113.
- de Lange FP, Koers A, Kalkman JS, Bleijenberg G, Hagoort P, van der Meer JW, Toni I. Increase in prefrontal cortical volume following cognitive behavioural therapy in patients with chronic fatigue syndrome. Brain 2008;131(8):2172-2180.
- Balasubramanian B, Portillo W, Reyna A, Chen JZ, Moore AN, Dash PK, Mani SK. Nonclassical mechanisms of progesterone action in the brain: II. Role of calmodulin-dependent protein kinase II in progesterone-mediated signaling in the hypothalamus of female rats. Endocrinology 2008;149(11):5518-5526.
- Lupien SJ, McEwen BS, Gunnar MR, Heim C. Effects of stress throughout the lifespan on the brain, behaviour and cognition. Nature Reviews Neuroscience 2009;10(6):434-445.
- Evans GW, Schamberg MA. Childhood poverty, chronic stress, and adult working memory. Proceedings of the National Academy of Sciences of the United States of America 2009;106(16):6545-6549.
- Farah MJ, Shera DM, Savage JH, Betancourt L, Giannetta JM, Brodsky NL, Malmud EK, Hurt H. Childhood poverty: Specific associations with neurocognitive development. Brain Research 2006; 1110(1):166-174.
- Fried LP, Carlson MC, Freedman M, Frick KD, Glass TA, Hill J, McGill S, Rebok GW, Seeman T, Tielsch J, Wasik BA, Zeger S. A social model for health promotion for an aging population: Initial evidence on the experience corps model. Journal of Urban Health 2004;81(1):64-78.
Notes
a Voir également le site Web du programme Nurse-Family Partnership. Disponible sur le site : http://www.nursefamilypartnership.org. Page consultée le 20 janvier 2010.
b Voir également Highscope Educational Research Foundation. HighScope Perry Preschool Study: Lifetime effects: The HighScope Perry Preschool Study through age 40;2005. Disponible sur le site : http://www.highscope.org/Content.asp?ContentId=219. Page consultée le 20 janvier 2010.
Pour citer cet article :
McEwen BS. Le cerveau : organe central du stress et de l’adaptation tout au long de la vie. Dans: Tremblay RE, Boivin M, Peters RDeV, eds. Encyclopédie sur le développement des jeunes enfants [en ligne]. https://www.enfant-encyclopedie.com/cerveau/selon-experts/le-cerveau-organe-central-du-stress-et-de-ladaptation-tout-au-long-de-la-vie. Publié : Juillet 2010. Consulté le 10 mars 2026.
Texte copié dans le presse-papier ✓