[Archivé] Immunisation de routine chez les jeunes enfants
Noni E. MacDonald, M.D., MSc, FRCPc
Dalhousie University, Canada
Introduction
Nos programmes de vaccination pour les jeunes enfants sont une des réussites majeures du 20e siècle en matière de santé publique. Ils ont changé l’image de l’enfance – en sauvant littéralement les vies de milliers d’enfants chaque année et en minimisant ou en éliminant les risques de plusieurs maladies graves chez les nourrissons et chez les enfants.1,2 À part l’eau potable, aucune autre modalité, pas même les antibiotiques, n’a eu un impact aussi important sur la réduction de la mortalité ou n’a provoqué une telle amélioration de la survie.3
Sujet
Calendrier de vaccination recommandée
Le Comité consultatif national de l'immunisation (CCNI) fournit au gouvernement fédéral (soit à Santé Canada) des conseils médicaux, scientifiques et de santé publique opportuns et continus sur la vaccination.1 Le calendrier actuel de vaccination (CCNI) recommandée pour les enfants est résumé dans le tableau 1.1,4 Étant donné qu’au Canada, la santé est une responsabilité provinciale et non fédérale, chaque province et chaque territoire décide individuellement si des vaccins particuliers seront inclus dans les programmes de vaccination qu’elle ou il finance, et si oui, lesquels et à quel moment.5 Malheureusement, cette approche a résulté en une couverture disparate et inégale des programmes de vaccinations pour les enfants dans notre pays.5,6 Par exemple, depuis décembre 2003, le CCNI a recommandé de nouveaux vaccins (les vaccins contre la varicelle,7 le pneumocoque conjugué,8 le méningocoque conjugué9 et la coqueluche acellulaire pour les adolescents10 [voir plus bas]) qui sont couramment disponibles dans quelques provinces et territoires.6 Malgré les nombreuses demandes en faveur d’une stratégie de vaccination nationale au Canada, nous n’en avons pas encore, contrairement aux États-Unis, à l’Australie, au Royaume-Uni et à d’autres pays.5,6,11-14
Avantages de la vaccination de routine chez les jeunes enfants : des vies sauvées
Il n’y a pas si longtemps, les parents et les intervenants en santé découvraient les conséquences potentielles de maladies pour les nourrissons et les jeunes enfants infectés. On peut désormais prévenir plusieurs maladies grâce à des programmes de vaccination de routine. Au début des années 1900, cinq enfants sur 1 000 nés au Canada et aux États-Unis mouraient de la coqueluche (toux convulsive) avant l’âge de cinq ans15 et la diphtérie (une maladie causée par une bactérie qui empêche d’avaler et de respirer) était l’une des causes les plus courantes de mortalité chez les enfants de un à cinq ans, tuant des milliers d’enfants chaque année.1 La poliomyélite (une maladie virale infectieuse qui affecte le système nerveux central) était un fléau estival très craint qui tuait souvent ou qui rendait handicapé.16 Le tableau 2 présente une comparaison de la prévalence des maladies avant et après l’introduction des vaccins de routine.1,2,8-10,15-18
Pour profiter des bienfaits de ces vaccins, les enfants doivent non seulement être vaccinés, mais ils doivent l’être à temps. Ces maladies peuvent encore tuer ou estropier, même si l’on a accès à des soins intensifs modernes et à des traitements à base d’antibiotiques.19-21 Au milieu des années 1990, beaucoup de familles de l’ex-URSS ont de nouveau appris le danger de la diphtérie et l’importance de la vaccination lorsque cette maladie a effectué une résurgence remarquée avec 115 000 cas et 3 000 décès rapportés.20 Cette vague s’est produite dans un pays où la diphtérie avait auparavant été bien contrôlée. La dislocation de l’ancienne URSS a amené de profonds changements sociaux qui ont entraîné une baisse considérable du taux de vaccination des nourrissons et des enfants et une incapacité à fournir des doses de rappel aux adultes. Les études avec des groupes témoins ont montré que ceux qui étaient vaccinés étaient protégés, et que ceux qui ne l’étaient pas étaient à risque.22 Cette tragique épidémie n’était pas attribuable à l’échec du vaccin, mais plutôt au manque de vaccination.
Problèmes
Les effets secondaires sont moins courants avec les vaccins qu’avec la maladie
Le tableau 3 présente les effets de la maladie et les effets secondaires connus du vaccin pour les maladies que l’on peut prévenir grâce à des vaccins de routine chez les nourrissons et chez les jeunes enfants.1,8-10,15-17 En général, toutes ces maladies sont graves et peuvent être mortelles, alors que les effets secondaires associés aux vaccins, s’ils se produisent, sont généralement mineurs et consistent en un inconfort local, en une inflammation à l’endroit de la piqûre, et en une fièvre légère ou en une rougeur. La recherche a montré que l’on peut diminuer la douleur localisée d’un vaccin intramusculaire de DCaT/VPI/Hib en utilisant un mélange de lidocaïne et de prilocaïne topiques sans affecter négativement le développement de la réponse protectrice du vaccin à composantes multiples.23 Chez le nourrisson, on peut réduire la douleur causée par les injections multiples effectuées pendant une même visite avec du saccharose oral, par la stimulation tactile orale (un biberon ou une tétine) ou en demandant au parent de prendre l’enfant dans ses bras.24
Des effets secondaires graves associés aux vaccins de routine se produisent, mais sont beaucoup plus rares et moins sérieux que les effets associés aux maladies.1,2,8-10,15-17 Par exemple, la méningite à liquide clair (une infection des membranes et du fluide enrobant le cerveau et la moelle épinière) se produit chez 5 % des patients qui ont les oreillons (une maladie virale qui entraîne le gonflement des glandes salivaires du menton et du visage) et la surdité permanente peut survenir chez presque 0,5 % des patients.1,2 En revanche, la méningite à liquide clair consécutive au vaccin contre les oreillons avec la souche Jeryl Lynn (le type de souche de vaccin viral modifié et dilué contre les oreillons et utilisé au Canada et dans plusieurs autres pays) se produit après moins d’une dose sur 800 000 et parfois seulement après une dose sur 3 millions.2,25 De plus, la méningite à liquide clair associée au vaccin n’est pas suivie de problèmes permanents comme la surdité.25
À part ces graves effets secondaires connus mais rares associés aux vaccins (tableau 3), il y a eu des allégations périodiques selon lesquelles les vaccins dispensés aux nourrissons pouvaient causer d’autres problèmes graves comme le syndrome de la mort subite du nourrisson26 et l’autisme.27 Cependant, la recherche a montré que ces affirmations ne sont pas fondées.28-31 Il n’y a pas de relation causale entre la vaccination du nourrisson et le syndrome de la mort subite du nourrisson ou l’autisme. Bien que l’on ait pu constater des incidents peu après l’administration d’un vaccin au nourrisson (c’est-à-dire en établissant une relation temporelle possible), l’administration du vaccin n’en était pas la cause.32,33
En 1994, Santé Canada a mis sur pied le Comité consultatif sur l'évaluation de la causalité (CCEC) afin d’évaluer les rapports sur les effets secondaires graves associés aux vaccins au Canada.33 Ce comité d’experts est chargé de la surveillance de la sécurité en matière de vaccins. Le comité révise régulièrement tous les rapports concernant les effets secondaires graves et inhabituels associés aux vaccins afin de déterminer, grâce à une approche systématique et standardisée, si la relation de cause à effet entre les effets secondaires et l’administration du vaccin est vraisemblable, probable, possible, peu vraisemblable, inclassable ou inexistante.33 Au niveau international, en 1999, l’Organisation mondiale de la Santé a mis sur pied le Comité consultatif mondial sur la Sécurité des Vaccins. Sa tâche consiste à réagir promptement, efficacement et avec la rigueur scientifique voulue aux problèmes de sécurité vaccinale pouvant avoir un impact mondial.34
En 1991, Santé Canada, en collaboration avec la Société canadienne de pédiatrie et d’autres collaborateurs, a mis à l’essai un réseau de surveillance pédiatrique active en milieu hospitalier dans cinq centres au Canada. Son objectif était d’améliorer la détection d’effets secondaires graves associés à des vaccins, d’identifier les échecs en matière vaccinale et de détecter les cas de maladies infectieuses sélectionnées déjà ou bientôt évitables grâce à des vaccins, chez le nourrisson et l’enfant, Le réseau a ensuite été étendu à 11 centres en 1995 et à 12 en 1999 (IMPACT).35-37 Les données compilées du réseau ont montré à plusieurs reprises que les vaccins de routine destinés aux jeunes enfants étaient très sécuritaires.38 De plus, IMPACT s’est révélé précieux pour détecter les effets secondaires rares mais inattendus (par exemple, des infections généralisées au Bacille Calmette-Guérin (BCG) chez les enfants autochtones vaccinés contre le BCG39) qui ont conduit à une réévaluation de la politique.40 IMPACT a aussi pu montrer une diminution notable de certaines maladies après l’introduction d’un nouveau vaccin41 et une diminution des effets secondaires après la transition vers le nouveau vaccin amélioré.42
Contexte de la recherche
Meilleures pratiques en matière de programmes de vaccination
En 1995, le CCNI a entrepris un processus consultatif de deux ans afin de développer des lignes directrices en matière de pratiques de vaccination applicables aux systèmes privé et public de prestation de vaccins au Canada. Le tableau 4 fournit un bref aperçu de ces lignes directrices.1 La recherche a démontré qu’un certain nombre de facteurs pouvaient améliorer le taux de vaccination, y compris les rappels opportuns, la qualité du matériel éducatif destiné aux parents, les cliniques ouvertes après les heures habituelles et les fins de semaine, le suivi de la prise du vaccin, les vaccins multiples administrés lors de la même visite, les commandes permanentes de vaccins, l’éducation à composantes multiples de la personne qui administre le vaccin et l’élimination des obstacles financiers à la vaccination.1,5,6,11,43-47
Pour ce qui est du consentement à la vaccination, la recherche a montré que ce qui compte pour les parents est de recevoir l’information nécessaire pour prendre une décision éclairée,46,48-50 mais que la façon dont cette information est dispensée n’est pas importante.49 L’édition 2002 du Guide canadien de l’immunisation du CCNI en a tenu compte et a ajouté un chapitre distinct sur la question du consentement et des préoccupations parentales sur la vaccination afin d’aider les intervenants à mieux conseiller les parents.1 Consciente que l’information sur les vaccins contenue dans le CCNI du Guide canadien de l’immunisation pouvait se révéler trop technique pour les parents, la Société canadienne de pédiatrie a soutenu le développement d’un manuel spécialement conçu à l’intention de ces derniers et intitulé Les vaccins : avoir la piqûre pour la santé de votre enfant, dont la première édition remonte à 1997. Depuis 2002, les éditions incluent les nouveaux vaccins recommandés par le CCNI.2
Tel que souligné plus haut, que les intervenants soient bien informés est un facteur important de l’amélioration du taux de vaccination,cependant, la recherche a montré que plusieurs d’entre eux ne le sont pas.45,46,50,51 Les efforts visant à palier ce manque de connaissances se résument à la réorganisation et à la mise à jour du Guide canadien de l’immunisation du CCNI, à l’éducation continue sur les vaccins pour les médecins et les infirmières, à des articles de revues, à davantage de recherche, à la formation de la Coalition canadienne pour la sensibilisation et la promotion de la vaccination,52 à la formation de l’Alliance canadienne de recherche en immunisation et en épidémiologie,53 et à la conférence canadienne biannuelle sur l’immunisation.54
Programmes de vaccination pour les enfants ayant des besoins spéciaux
Bien que le calendrier de vaccination de routine du CCNI (voir tableau 1) soit approprié pour la majorité des enfants canadiens, certains sous-groupes ont des besoins spéciaux :
- les nourrissons et les jeunes enfants nés à l’extérieur du Canada qui arrivent comme immigrants, réfugiés, étrangers adoptés, qui peuvent ne pas avoir reçu tous les vaccins recommandés au Canada et qui ne possèdent pas nécessairement la documentation adéquate concernant leur vaccination;
- les prématurés;
- les nourrissons et les enfants qui sont immunocompromis à la naissance ou à cause d’une maladie;
- les nourrissons et les enfants qui ont des problèmes de saignement ou qui ont une rate non fonctionnelle ou absente;
- les nourrissons et les enfants qui voyagent vers d’autres pays.1 Dans chaque cas, les exigences en matière de vaccination et les calendriers peuvent devoir être adaptés.1,55,56
Récents résultats de recherche
Nouveaux vaccins recommandés par le CCNI pour les jeunes enfants
Trois vaccins récemment recommandés par le CCNI pour les nourrissons et les jeunes enfants ne sont pas encore couverts par des programmes de vaccination subventionnés dans toutes les provinces et tous les territoires.6 Il s’agit du vaccin contre la varicelle,7 du pneumocoque conjugué pour prévenir l’infection sanguine, la pneumonie et la méningite dues à la bactérie du pneumocoque,8 et du vaccin conjugué contre le méningocoque pour prévenir la méningite et l’infection sanguine encore due au méningocoque.9 Les risques de ces maladies, les bienfaits des vaccins et leurs effets secondaires sont résumés dans les tableaux 2 et 3. Dans les trois cas, on a démontré que ces vaccins étaient sécuritaires et efficaces pour prévenir les maladies graves chez les nourrissons et chez les jeunes enfants, mais chaque vaccin est aussi relativement coûteux comparé au prix des vaccins « réguliers » pour les nourrissons.57 Les coûts prohibitifs de ces vaccins se sont traduits par des retards et des disparités pour ce qui est de leur ajout à la liste de vaccins « de routine » couverts par chaque province et territoire.5,6,47 Un problème similaire existe pour le vaccin contre la coqueluche acellulaire pour les adolescents et les adultes. Bien que le vaccin contre la coqueluche acellulaire soit disponible dans tout le pays pour les nourrissons et pour les jeunes enfants, le vaccin acellulaire pour les adolescents et pour les adultes n’est pas encore couramment disponible au pays, et ce, malgré les recommandations du CCNI. L’utilisation répandue de ce vaccin chez les adolescents et les adultes peut diminuer la coqueluche dans les familles et ainsi diminuer l’exposition à cette maladie des nourrissons qui sont trop jeunes pour être vaccinés (c’est-à-dire âgés de moins de six semaines), et qui forment le groupe le plus à risque de maladie mortelle.58
Conclusions
Les vaccins recommandés pour les jeunes enfants sont des moyens sécuritaires et efficaces d’éliminer ou de diminuer les risques de plusieurs maladies graves chez le nourrisson et chez l’enfant. Les nourrissons et les enfants qui ne sont pas vaccinés continuent à être à risque. Le Guide canadien de l’immunisation1 du CCNI est la meilleure source d’information et la plus détaillée en ce qui concerne tous les aspects de la vaccination pour les intervenants et Les vaccins : avoir la piqûre pour la santé de votre enfant2 fournit de l’information de qualité aux parents.
Implications
On a besoin d’un programme national de vaccination afin d’améliorer l’égalité d’accès à tous les vaccins recommandés par le CCNI pour les nourrissons et les jeunes enfants de ce pays. Ce programme permettrait aussi de protéger tous nos enfants des dommages potentiels occasionnés par une maladie que l’on peut prévenir grâce à un vaccin. Si l’on ne garantit pas l’égalité d’accès, cela signifie que plusieurs nourrissons et enfants demeureront à risque de problèmes, comme la surdité causée par la méningite causée par l’infection au pneumocoque, ainsi que ses implications développementales sérieuses. Les décideurs politiques aux niveaux fédéral, provincial et territorial doivent travailler ensemble pour garantir un programme national de vaccination aux nourrissons et aux enfants canadiens pour que tous aient accès aux vaccins recommandés par le CCNI.
TABLEAU 1
Calendrier de vaccination recommandée par le CCNI pour les nourrissons et les enfants (références 1, 8-10, 15-18)
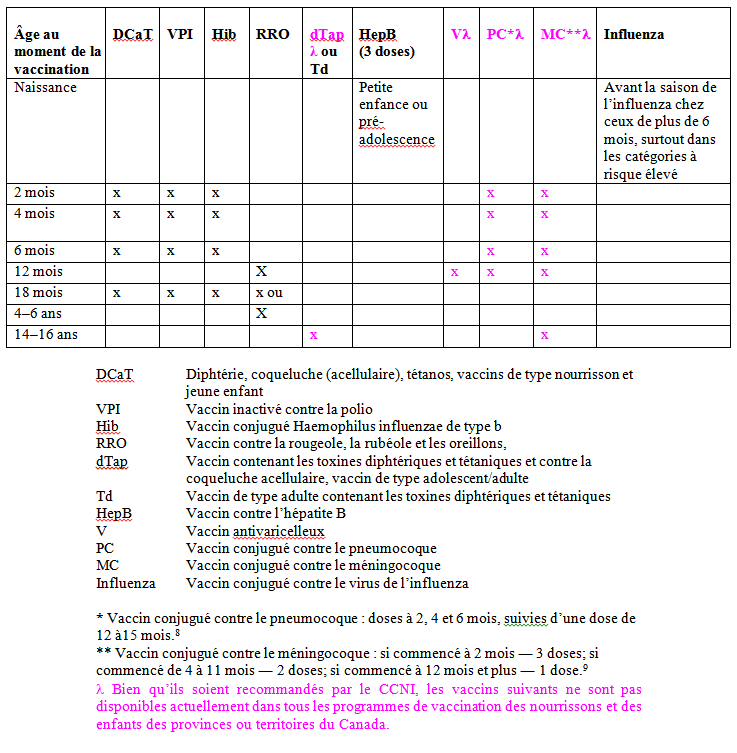
TABLEAU 2
Maladies graves chez les nourrissons, les enfants et les jeunes au Canada dans les périodes pré et post vaccination (d’après les références 1, 2, 8-10,15-18)
| Maladie / Organisme | Incidence avant la vaccination | Incidence après la vaccination |
|---|---|---|
|
Polio |
2,5 à 28,3/100 000 Épidémie : jusqu’à 20 000 cas de paralysie. |
Maladie éradiquée au Canada et dans la plupart des pays du monde. |
| Diphtérie |
En 1924, 9 000 cas rapportés. Principale cause de décès chez les enfants de 1 à 5 ans. |
Aucun cas rapporté depuis 1996, et avant cette date, seulement 2 à 5 par an. |
|
Tétanos (contracture de la mâchoire) |
60 à 75 cas par an, 40 à 50 décès. |
Moins de 2 cas par an au cours des 15 dernières années. |
| Coqueluche (toux convulsive) |
Plus de 150/100 000 cas par an et entre 50 à 100 décès. |
10/100 000 cas par an et 1 à 3 décès chez les très jeunes enfants. |
| Haemophilus influenzae type b |
2 000 cas par an dont 1 500 chez les <5 ans. Principale cause de méningite bactérienne dans la prime enfance. |
Moins de 50 cas par an. Rare cause de méningite bactérienne chez les nourrissons. |
| Rougeole |
Épidémies cycliques tous les 2 à 3 ans. 300 000 à 400 000 cas par an. |
Désormais moins de 400 cas par an. |
| Oreillon |
Environ 30 000 cas rapportés par an mais davantage non rapportés. |
Mois de 500 cas par an. |
| Rubéole |
Environ 250 000 cas par an, et 200 cas de syndrome congénital de la rubéole par an. |
Moins de 100 cas rapportés par an, 1 à 2 cas de syndrome congénital de la rubéole par an. |
| Influenza |
Épidémies annuelles, jusqu’à 20 % de la population est infectée. Grande variation de l’incidence annuelle. Dernière éruption importante : 1968 avec 50 millions de cas et 33 000 décès. |
Comme le virus de l’influenza change chaque année, une vaccination annuelle est requise. Le programme actuel cible les personnes à risque élevé et offre des doses en quantités limitées pour les personnes moins à risque. Si le vaccin est adéquat pour l’influenza dans la communauté et s’il est immunocompétent, on arrive à prévenir 70 à 90 % de la maladie. S’il n’est pas adéquat, il protège à 30 à 60 % de la population vaccinée seulement. Il est moins efficace s’il est non immunocompétent. |
| Hépatite B |
20 000 nouvelles infections par an, 1 personne sur 200 est porteuse chronique. La CBa eu un taux de 33,7/100 000 en 1992. Le risque de transmission d’une mère infectée à son nouveau-né est de 90 %. |
De 1992 à 2002 en CB, après avoir adopté un programme de vaccin chez les enfants de 6eannée, le taux général d’infection aiguë est tombé de 7 à 2/100 000 et chez les 12 à 21 ans de 1,7 à 0/100 000. La vaccination des nouveau-nés prévient la transmission mère enfant dans > 90 % des cas. |
| Varicelle |
Infection chez 50 % des enfants avant 5 ans et chez 90 % des enfants avant 12 ans. |
Aux États-Unis, les décès attribuables à la varicelle ont diminué de 76 % avec le programme national et les taux de couverture de 80 % chez les moins de 3 ans. |
| Pneumonie due au streptocoque |
Environ 500 000 cas de maladies attribuables au pneumocoque par an dont plus de 200 000 chez les enfants de moins de 5 ans. Taux d’infections invasives à streptocoque |
Vaccin conjugué heptavalent pour les nourrissons a obtenu sa licence au Canada seulement en 2001. Aux États-Unis, les essais cliniques chez les enfants ont montré que le vaccin était efficace à 94 % pour les infections invasives si le vaccin était immunocompétent, et à 89 % pour les infections invasives de n’importe quelle souche de pneumocoque. |
|
Neisseria meningitidis |
Endémique au Canada avec des épidémies tous les 10 à 15 ans. 200 à 300 cas endémiques par an. Les taux dans les 3 groupes d’âges les plus élevés sont : <1 an 11,3/100 000; Sérogroupes en 2001 : |
Le vaccin conjugué de groupe C pour les nourrissons a obtenu sa licence au Canada en 2001 seulement. Au Royaume-Uni, l’immunisation de routine chez les nourrissons a commencé en 1999 avec une campagne de suivi pour les enfants et les adolescents. Elle a diminué la maladie de >90 %. |
TABLEAU 3
Comparaison des effets des maladies graves chez le nourrisson et l’enfant et des effets négatifs des vaccins (références 1, 2, 8-10, 15-17)
| Maladie / Organisme |
Incidence avant la vaccination |
Incidence après la vaccination |
|
Polio |
4 à 8 % ont une maladie mineure, 1 % ont une polio paralytique grave, 1 patient hospitalisé sur 20 décède et 50 % des patients restent paralysés. |
Inconfort ou rougeur localisé à l’endroit de l’injection chez 5 % des sujets.Vaccin inactivé, donc aucun risque de polio associée au vaccin. |
|
Diphtérie |
5 à 10 % des cas décèdent même s’ils sont traités dans des unités de soins intensifs, avec des antitoxines et des antibiotiques. La toxine peut provoquer des complications neurologiques et cardiaques. |
Vaccin DCaT donc : inconfort localisé, enflure ou rougeur à l’endroit de l’injection chez 20 % des sujets, fièvre chez 5 % des sujets.Un nodule passager peut se produire à l’endroit de l’injection et durer quelques semaines. Près de 70 % ont une rougeur et une enflure lors du rappel 4 à 6 ans plus tard. |
|
Tétanos (contracture de la mâchoire) |
10 % des cas décèdent, malgré des traitements dans des unités de soins intensifs, des antitoxines et des antibiotiques. Le risque est plus élevé pour les très jeunes enfants et pour les personnes très âgées. |
Voir ci-dessus pour le DCaT. Les réactions localisées augmentent avec l’âge, surtout chez les adultes qui reçoivent une dose de rappel. On a rarement rapporté des séquelles au nerf périphérique (<1/1 000 000). |
|
Coqueluche (toux convulsive) |
1/400 nourrisson qui a la coqueluche décède, 1/400 subit des dommages permanents au cerveau. Si âgés de moins de 6 mois, 1 % des enfants meurent de pneumonie ou de privation mortelle d’oxygène au cerveau. |
Idem ci-dessus.Bien moins d’effets secondaires avec le vaccin contre la coqueluche acellulaire (Ca) qu’avec le vaccin précédent à cellule entière (C). |
|
Haemophilus influenzae type b |
5 % des cas de méningite décèdent, 10 à 15 % ont des dommages permanents au cerveau et 10 à 20 % de la surdité. |
Habituellement combiné, comme pour le DCaT/VPI/Hib. Voir plus haut pour les effets secondaires (identiques à ceux du DCaT). |
|
Rougeole |
10 % ont des complications comme la pneumonie, les infections à l’oreille. 1/1 000 a une encéphalite (infection du cerveau), 10 % décèdent et 25 % subissent des dommages permanents au cerveau, 1/25 000 a une panencéphalite subaiguë sclérosante (PESS) (une maladie mortelle dégénérative du cerveau qui survient plus tard). |
Généralement combiné, comme le RRO. 5 à 10 % ressentent un inconfort ou une enflure localisé et de la fièvre, avec ou sans démangeaison. 1/24 000 a un faible taux de plaquettes <1/1 000 000 a une encéphalite. |
|
Oreillon |
1/20 développe une méningite aseptique (infection virale des tissus et des fluides autour du cerveau). 1/200 développe une encéphalite. 1/200 000 reste sourd. Inflammation des testicules chez 20 à 30 % des hommes; inflammation des ovaires chez 5 % des femmes postpubertaires. |
Inconfort localisé, enflure et rougeur ou fièvre dans 5 à 10 % des cas. 1 % développe une parotidite (enflure de la plus grande glande salivaire, la parotide). 1 personne sur 3 millions développe la méningite aseptique. |
|
Rubéole |
50 % ont des démangeaisons, des glandes enflées, de la fièvre; 50 % des adolescents et des adultes font de l’arthrite et de l’arthralgie; 1/6 000 a une encéphalite. Dans les 10 premières semaines de grossesse, 85 % de risque de syndrome de la rubéole congénitale qui cause la mort du fœtus, la surdité, la cécité et/ou une maladie coronarienne. |
10 % ont un inconfort localisé et de la fièvre, 5 % des glandes enflées, de l’arthralgie (particulièrement les adultes) et une raideur au cou. 1 % développe des démangeaisons non infectieuses. |
|
Influenza |
Taux de mortalité le plus élevé chez les plus de 65 ans et chez les enfants de moins d’un an. Complications : pneumonie, attaques fiévreuses, encéphalite, myocardite, myosite, encéphalite virale (syndrome de Reyes). |
Faibles réactions locales à l’endroit de l’injection et faible fièvre pendant 1 à 3 jours chez près de 60 % des sujets. Parfois faible syndrome oculo-respiratoire. Rare : syndrome de Guillian-Barré 1/1 000 000. |
|
Hépatite B |
Variable : maladie du foie asymptomatique à fulgurante. Asymptomatique chez les nouveau-nés, 5 à 15 % des 1 à 5 ans ont des symptômes, 33 à 50 % des enfants plus âgés ont des nausées, la jaunisse, de la fièvre, des vomissements, un foie et une rate enflés. < 1 % ont une défaillance hépatique fulminante et mortelle. Maladie chronique chez 90 % des bébés, 25 à 50 % des enfants de 1 à 5 ans et 6 à 10 % des enfants plus âgés. Risque de cancer au foie, de défaillance hépatique et de maladie chronique. |
15 % ont un inconfort localisé et parfois une faible fièvre. |
|
Varicelle |
Taux de mortalité de 1 à 3 /100 000 cas chez les enfants. Complications chez 5 à 10 % des enfants antérieurement en bonne santé : pneumonie, encéphalite (1/5 000), ataxie cérébelleuse (1/4 000), ostéomyélite, hépatite, arthrite septique. Chez 50 % des enfants qui ont une infection à bactérie mangeuse de chair (fasciite nécrosante), la varicelle précède cette maladie. Zona chez l’adulte. Syndrome congénital de la varicelle. |
15 à 20 % souffrent d’enflures légères, d’inconfort à l’endroit de l’injection et de fièvre.1 à 5 % souffrent de faibles démangeaisons. |
|
Pneumonie due au streptocoque |
Cause principale de maladie bactériologique invasive chez les jeunes enfants. Nombre de cas par an : 65 méningites (perte d’audition 20 à 30 %, dommages au cerveau 15 à 20 %), 700 cas de bactériémie, 2 200 cas de pneumonie nécessitant une hospitalisation, 9 000 cas de pneumonie ne nécessitant pas une hospitalisation. Taux de décès<6 mois 4,3 %, 12 ans 2 %. 15 décès/an chez les <5 ans. Les patients atteints d’une anémie à hématies falciformes ou du VIH sont plus à risque de maladies graves. |
Vaccin conjugué heptavalent bien toléré par les nourrissons et les jeunes enfants. Faibles réactions chez 10 à 15 % des sujets. |
|
Neisseria meningitidis |
Méningite 30 à 50 % (TM 5 %), méningite + bactériémie 40 %, bactériémie seule 7 à 10 % (TM 20 à 40 %). Autres complications : arthrite, pneumonie, péritonite.Taux de mortalité 10 % malgré soins intensifs/antibiotiques. Plus haut taux de mortalité (TM) : <1 an 1/100 000. |
Nourrisson/jeunes enfants, vaccin C conjugué : faibles réactions localisées moins courantes qu’avec le DCaT/VPI/Hib, les réactions graves sont très rares. |
TABLEAU 4
Lignes directrices nationales pour l’immunisation des enfants : résumé*
| 1 |
Les services de vaccination devraient être facilement disponibles. |
| 2 |
Il ne devrait y avoir aucun obstacle ou préalables superflus à la réception des vaccins. |
| 3 |
Les intervenants devraient profiter de toutes les rencontres cliniques pour dépister les besoins en matière de vaccination, et vacciner les enfants lorsque nécessaire. |
| 4 |
Les intervenants devraient informer les parents de la vaccination, dans ses grandes lignes. |
| 5 |
Les intervenants devraient utiliser des termes spécifiques pour informer les parents des risques et des avantages des vaccins que leur enfant va recevoir. |
| 6 |
Les intervenants devraient recommander de reporter ou de suspendre l’administration des vaccins uniquement dans les cas de contre-indications réelles. |
| 7 |
Les intervenants devraient administrer toutes les doses de vaccins auxquelles l’enfant est admissible au moment de chaque visite. |
| 8 |
Les intervenants devraient s’assurer que tous les vaccins sont entièrement et correctement notés au dossier. |
| 9 |
Les intervenants devraient maintenir des résumés facilement accessibles des listes de vaccination pour faciliter la vaccination appropriée à l’âge du sujet. |
| 10 |
Les intervenants devraient rapporter les effets secondaires cliniquement importants de la vaccination dans leur totalité et avec exactitude. |
| 11 |
Les intervenants devraient rapporter tous les cas de maladies qui peuvent être prévenues par des vaccins tel que requis par les législations provinciales et territoriales. |
| 12 |
Les intervenants devraient adhérer à des procédures appropriées de gestion de la vaccination. |
| 13 |
Les intervenants devraient maintenir des protocoles à jour et facilement accessibles dans tous les endroits où les vaccins sont administrés. |
| 14 |
Les intervenants devraient recevoir une formation adéquate et de l’éducation continue sur les recommandations au sujet de la vaccination. |
| 15 |
Les intervenants devraient gérer un système de suivi. |
| 16 |
Une vérification devrait être effectuée dans toutes les cliniques de vaccination pour évaluer la qualité des rapports de vaccination et les niveaux de couverture de la vaccination. |
* Adapté à partir du Guide canadien de l’immunisation, 6è édition.1
Références
- National Advisory Committee on Immunization. Canadian Immunization Guide. 6th ed. Ottawa, Ontario: Health Canada; 2002. Disponible sur le site: http://dsp-psd.communication.gc.ca/Collection/H49-8-2002E.pdf. Page consultée le 24 novembre 2004.
- Gold R. Your child’s best shot: a parent’s guide to vaccination. 2nd ed. Ottawa, Ontario: Canadian Paediatric Society; 2002.
- Plotkin SL, Plotkin SA. A short history of vaccination. In: Plotkin SA, Orenstein WA, eds. Vaccines. 3rd ed. Philadelphia, Pa: WB Saunders Co; 1999:1-12.
- Division of Immunization and Respiratory Diseases. Population and Public Health Branch. Health Canada. Immunization Schedule. Disponible sur le site: http://www.phac-aspc.gc.ca/im/index.html. Page consultée le 24 novembre 2004.
- Naus M, Scheifele DW. Canada needs a national immunization program: an open letter to the Honourable Anne McLellan, federal minister of health. CMAJ - Canadian Medical Association Journal 2003;168(5):567-568.
- Infectious Diseases and Immunization Committee, Canadian Paediatric Society. Routine immunization schedule: Update 2004. Peadiatric Child Health 2004;9(1):17-20. Disponible sur le site: http://www.cps.ca/english/statements/ID/PIDNoteImmunization.htm. Page consultée le 24 novembre 2004.
- National Advisory Committee on Immunization. Update on varicella. CCDR - Canadian Communicable Disease Report 2004;30(ACS-1):1-28. Disponible sur le site: http://www.phac-aspc.gc.ca/publicat/ccdr-rmtc/04pdf/acs-dcc-30-1.pdf. Page consultée le 24 novembre 2004.
- National Advisory Committee on Immunization. Statement on recommended use of pneumococcal conjugate vaccine. CCDR - Canadain Communicable Disease Report 2002;28(ACS-2):1-32. Disponible sur le site: http://www.phac-aspc.gc.ca/publicat/ccdr-rmtc/02pdf/acs28-2.pdf. Page consultée le 24 novembre 2004.
- National Advisory Committee on Immunization. Statement on recommended use of meningococcal vaccines. CCDR - Canadian Communicable Disease Report 2001;27(ACS-6):2-36. Disponible sur le site: http://www.phac-aspc.gc.ca/publicat/ccdr-rmtc/01pdf/acs27-5-6.pdf. Page consultée le 24 novembre 2004.
- National Advisory Committee on Immunization. Prevention of pertussis in adolescents and adults. CCDR - Canadian Communicable Disease Report 2003;29(ACS-5):1-9. Disponible sur le site: http://www.phac-aspc.gc.ca/publicat/ccdr-rmtc/03pdf/acs-dcc-29-5-6.pdf . Page consultée le 24 novembre 2004.
- Lynk A. A call to arms (and legs): Implement the National Immunization Strategy. Peadiatrics and Child Health 2002;7(2):615-616.
- Romanow RJ, commisionner. Building on values: The future of health care in Canada. Final report. Saskatoon, Saskatchewan: Commission on the Health Care in Canada; 2002. Disponible sur le site: http://www.hc-sc.gc.ca/english/care/romanow/hcc0086.html. Page consultée le 24 novembre 2004.
- National Immunization Strategy. In: Budget 2003. Investing in Canada’s Health Care System. Canada: Department of Finance; 2003:15. Disponible sur le site: http://www.fin.gc.ca/budget03/booklets/bkheae.htm. Page consultée le 24 novembre 2004.
- National Advisory Committee on SARS and Public Health. Learning from SARS - Renewal of public health in Canada. Ottawa: Health Canada; 2003. Disponible sur le site: http://www.phac-aspc.gc.ca/sars-sras/index.html.. Page consultée le 24 novembre 2004.
- Cherry JD, Brunell PA, Golden GS, Karson DT. Report of the task force on pertussis and pertussis immunization. Pediatrics 1988;81(suppl):939-984.
- Rutty CJ. The middle-class plague: epidemic polio and the Canadian state, 1936-1937. Bulletin Canadien d'Histoire de la Médecine / Canadian Bulletin of Medical History 1996;13(2):277-314. Disponible sur le site: http://www.healthheritageresearch.com/MCPlague.html. Page consultée le 24 novembre 2004.
- Patrick DM, Bigham M, Ng H, White R, Tweed A, Skowronski DM. Elimination of acute hepatitis B among adolescents after one decade of an immunization program targeting Grade 6 students. Pediatric Infectious Disease Journal 2003;22(10):874-877.
- Immunization and Respiratory Infections Division, Centre for Infectious Disease Prevention and Control. Enhanced surveillance of invasive meningococcal disease in Canada: 1 January, 1999, through 31 December, 2001. CCDR - Canada Communicable Disease Report 2004;30(3):17-28. Disponible sur le site: http://www.phac-aspc.gc.ca/publicat/ccdr-rmtc/04vol30/dr3003ea.html. Page consultée le 24 novembre 2004.
- Samba E, Nkrumah F, Leke R. Getting polio eradication back on track in Nigeria. New England Journal of Medicine 2004;350(7):645-646.
- Markina SS, Maksimova NM, Vitek CR, Bogatyreva EY, Monisov AA. Diphtheria in the Russian Federation in the 1990s. Journal of Infectious Diseases 2000;181(Suppl 1):S27-S34.
- Grewal S, Scheifele D. Haemophilus influenzae type b disease at 11 pediatric centres, 1996-1997. CCDR - Canada Communicable Disease Report 1998;24(13):105-108. Disponible sur le site: http://www.phac-aspc.gc.ca/publicat/ccdr-rmtc/98vol24/dr2413ea.html. Page consultée le 24 novembre 2004.
- Bisgard KM, Rhodes P, Hardy IRB, Litkina IL, Filatov NN, Monisov AA, Wharton M. Diphtheria toxoid vaccine effectiveness: A case controlled study in Russia. Journal of Infectious Diseases 2000;181(Suppl 1):S184-S187.
- Halperin BA, Halperin SA, McGrath P, Smith B, Houston T. Use of lidocaine-prilocaine patch to decrease intramuscular injection pain does not adversely affect the antibody response to diphtheria-tetanus-acellular pertussis-inactivated poliovirus-Haemophilus influenzae type b conjugate and hepatitis B vaccines in infants from birth to six mois of age. Pediatric Infectious Disease Journal 2002;21(5):399-405.
- Reis EC, Roth EK, Syphan JL, Tarbell SE, Holubkov R. Effective pain reduction for multiple immunization injections in young infants. Archives of Pediatrics and Adolescent Medicine 2003;157(11):1115-1120.
- Plotkin SA, Wharton M. Mumps Vaccine. In: Plotkin SA, Orenstein WA, eds. Vaccines. 3rd ed. Philadelphia, Pa: WB Saunders Co.; 1999:279-281.
- Baraff LJ, Ablon WJ, Weiss RC. Possible temporal association between diphtheria-tetanus toxoid-pertussis vaccination and sudden infant death syndrome. Pediatric Infectious Disease Journal 1983;2(1):7-11.
- Wakefield AJ, Murch SH, Anthony A, Linnell J, Casson DM, Malik M, Berlowitz M, Dhillon AP, Thomson MA, Harvey P, Valentine A, Davies SE, Walker-Smith JA. Ileal-lymphoid-nodular hyperplasia, non-specific colitis, and pervasive developmental disorder in children (Retracted article. See vol 363, pg 750, 2004). Lancet 1998;351(9103):637-641.
- Howson CP, Howe CJ, Fineberg HV, eds; Committee to Review the Adverse Consequences of Pertussis and Rubella Vaccines, Institute of Medicine. Adverse effects of pertussis and rubella vaccines. Washington, DC: National Academies Press; 1991.
- Strauss B, Bigham M. Does measles-mumps-rubella (MMR) vaccination cause inflammatory bowel disease and autism? CCDR - Canada Communicable DiseaseReport 2001;27(8):65-72. Disponible sur le site: http://www.phac-aspc.gc.ca/publicat/ccdr-rmtc/01vol27/dr2708ea.html. Page consultée le 24 novembre 2004.
- Stratton K, Gable A, Shetty P, McCormick M, eds. Immunization Safety Review: Measles-Mumps-Rubella Vaccines and Autism. Washington, DC: Institute of Medicine, National Academies Press; 2001. Disponible sur le site: http://www.nap.edu/books/0309074479/html/. Page consultée le 24 novembre 2004.
- Wilson K, Mills E, Ross C, McGowan J, Jadad A. Association of autistic spectrum disorder and the measles, mumps and rubella vaccine. A systematic review of current epidemiological evidence. Archives of Pediatrics and Adolescent Medicine 2003;157(7):628-634.
- Stratton KR, Howe CJ, Johnston RB, eds. Adverse Events Associated with Childhood Vaccines. Evidence Bearing on Causality. Washington, DC: Institute of Medicine. National Academies Press; 1994.
- Collett JP, MacDonald N, Cashman N, Pless R, Advisory Committee on Causality Assessment. Monitoring signals for vaccine safety: the assessment of individual adverse event reports by an expert advisory committee. Bulletin of the World Health Organization 2000;78(2):178-185.
- World Health Organization. Global Advisory Committee on Vaccine Safety (GACVS). Disponible sur le site: http://www.who.int/vaccine_safety/en/. Page consultée le 24 novembre 2004.
- Canadian Paediatric Society. IMPACT - Immunization Monitoring Program - ACTive. Disponible sur le site: http://www.cps.ca/English/surveillance/IMPACT/IMPACT.htm. Page consultée le 24 novembre 2004.
- Morris R, Halperin SA, Dery P, Mills E, Lebel M, MacDonald N, Gold R, Law B, Jadavji T, Scheifele DW, Marchessault V, Duclos P: IMPACT monitoring network: A better mousetrap. Canadian Journal of Infectious Diseases 1993;4(4):194-195.
- Scheifele DW, Halperin SA, CPS/Health Canada, Immunization Monitoring Program, Active (IMPACT). Immunization Monitoring Program, Active: a model of active surveillance of vaccine safety. Seminars in Pediatric Infectious Diseases 2003;14(3):213-219.
- Scheifele DW, Halperin SA, Gold R, Samson H, King A, Canadian Paediatric Society/Health Canada Immunization Monitoring Program, ACtive (IMPACT). Assuring vaccine safety: a celebration of 10 years of progress with the IMPACT project. Paediatrics and Child Health 2002;7(9):645-648. Disponible sur le site: http://www.pulsus.com/Paeds/07_09/sche_ed.htm. Page consultée le 24 novembre 2004.
- Scheifele D, Law B, Jadavji T, on behalf of IMPACT. Disseminated Bacille Calmette-Guerin Infection: Three recent Canadian cases. CCDR - Canada Communicable Disease Report 1998;24(9):69-75. Disponible sur le site: http://www.phac-aspc.gc.ca/publicat/ccdr-rmtc/98vol24/dr2409ea.html. Page consultée le 24 novembre 2004.
- Elwood K. Bacille Calmette-Guérin vaccination. In: Long R, ed. Canadian Tuberculosis Satandards. 5th ed. Ottawa, Ontario: Health Canada, Canadian Lung Association; 2000: 223-228. Disponible sur le site: http://www.phac-aspc.gc.ca/publicat/cts-ncla00/pdf/cts00.pdf. Page consultée le 24 novembre 2004.
- Scheifele D, Halperin S, on behalf of IMPACT. Haemophilus influenzae type b disease control using Pentacelä, Canada, 1998-1999. CCDR - Canada Communicable Disease Report 2000;26(11):93-96. Disponible sur le site: http://www.phac-aspc.gc.ca/publicat/ccdr-rmtc/00vol26/dr2611ea.html. Page consultée le 24 novembre 2004.
- Le Saux N, Barrowman NJ, Moore DL, Whiting S, Scheifele D, Halperin S, for Members of the Canadian Paediatric Society/ Health Canada Immunization Monitoring Program–Active (IMPACT). Decrease in hospital admissions for febrile seizures and reports of hypotonic-hyporesponsive episodes presenting to hospital emergency departments since switching to acellular pertussis vaccine in Canada: a report from IMPACT. Pediatrics 2003;112(5):e348-e348. Disponible sur le site: http://www.pediatrics.org/cgi/content/full/112/5/e348. Page consultée le 24 novembre 2004.
- DuPlessis HM, Bell WC, Boulter SC, Cora-Bramble D, Feild C, Handal GA, Katcher ML, Rushton FE, Wood DL, Lavin A, Melinkovich P, Belardo JH, Rodewald LE, Varrasso DA, Mejia CA, Yasuda KE, Hammer LD, Harbaugh NR, Itkin PG, Jakubec PJ, Walker RD, France FL, Herr TJ, Lieberthal AS, Swanson J, Grimm KT, Bien AA, Davis T, Price WS, Sebring RH. Increasing immunization coverage. Pediatrics 2003;112(4):993-996.
- Bjornson GL, Scheifele DW, Lajeunesse C, Bell A. Effect of reminder notices on the timeliness of early childhood immunizations. Paediatrics and Child Health 1999;4(6):403-408.
- Boulianne N, Deceuninck G, Duval B, Lavoie F, Dionne M, Carsley J, Valiquette L, Rochette L, De Serres G. Why are some children incompletely vaccinated at the age of 2? [in French]. Canadian Journal of Public Health. Revue Canadienne de Sante Publique 2003;94(3):218-223.
- de Courval FP, De Serres G, Duval B. Varicella vaccine: factors influencing uptake. Canadian Journal of Public Health. Revue Canadienne de Sante Publique 2003;94(4):268-271.
- Scheifele DW. New vaccines and the rising costs of caring. Paediatrics and Child Health 2000;5(7):371-372. Disponible sur le site: http://www.pulsus.com/Paeds/05_07/sche_ed.htm. Page consultée le 24 novembre 2004.
- Ball LK, Evans G, Bostrom A. Risky buisness: Challenges in vaccine risk communication. Pediatrics 1998;101(3):453-458.
- Bjornson GL, Scheifele DW, Gold R. Assessment of parent education methods for infant immunization. Canadian Journal of Public Health. Revue Canadienne de Sante Publique 1997;88(6):405-408.
- Gust DA, Woodruff R, Kennedy A, Brown C, Sheedy K, Hibbs B. Parental perceptions surrounding risks and benefits of immunization. Seminars in Pediatric Infectious Diseases 2003;14(3):207-212.
- Dionne M, Boulianne N, Duval B, Lavoie F, Laflamme N, Carsley J, Valiquette L, Gagnon S, Rochette L, De Serres G. Lack of conviction about vaccination in certain Quebec vaccinators [in French]. Canadian Journal of Public Health. Revue Canadienne de Sante Publique 2001;92(2):100-104.
- The Canadian Coalition for Immunization Awareness and Promotion / Coalition canadienne pour la sensibilisation et la promotion de la vaccination. Disponible sur le site: http://www.immunize.cpha.ca. Page consultée le 24 novembre 2004.
- The Canadian Association for Immunization for Research and Evaluation / Association canadienne pour la recherche et l’évaluation en immunisation. Disponible sur le site: http://www.caire.ca/. Page consultée le 24 novembre 2004.
- Health Canada. Proceedings of the Canadian National Immunization Conference. Canada’s National Immunization Strategy: From Vision to Action. Victoria BC. Dec1-3, 2002. CCDR - Canada Communicable Disease Report 2003;29(S4):1-24. Disponible sur le site: http://www.phac-aspc.gc.ca/publicat/ccdr-rmtc/03pdf/29s4e.pdf. Page consultée le 24 novembre 2004.
- Health Canada. Population and Public Health Branch. Travel Medicine Program. Disponible sur le site: http://www.travelhealth.gc.ca. Page consultée le 24 novembre 2004.
- Children and youth new to Canada: A health care guide. Ottawa, Ontario: Canadian Paediatric Society; 1999.
- Tengs TO, Adams ME, Pliskin JS, Safran DG, Siegel JE, Weinstein MC, Graham JD. Five-hundred life-saving interventions and their cost-effectiveness. Risk Analysis 1995;15(3):369-390.
- Mikelova LK, Halperin SA, Scheifele D, Smith B, Ford-Jones E, Vaudry W, Jadavji T, Law B, Moore D, members of the Immunization Monitoring Program, Active (IMPACT). Predictors of death in infants hospitalized with pertussis: a case-control study of 16 pertussis deaths in Canada. Journal of Pediatrics 2003;143(5):576-581.
Pour citer cet article :
MacDonald NE. [Archivé] Immunisation de routine chez les jeunes enfants. Dans: Tremblay RE, Boivin M, Peters RDeV, eds. Scheifele DW, éd. thème. Encyclopédie sur le développement des jeunes enfants [en ligne]. https://www.enfant-encyclopedie.com/vaccination/selon-experts/immunisation-de-routine-chez-les-jeunes-enfants. Publié : Novembre 2004. Consulté le 19 avril 2024.
Texte copié dans le presse-papier ✓